Российская академия образования
Институт общего среднего образования РАО
Центр дистанционного образования "Эйдос"
Материалы 2-го Всероссийского конкурса
Физика. 10 класс.
Урок 2.
Размеры и масса молекул.
Свойства и поведение тел, в процессах передачи и превращения энергии, определяются движением взаимодействующих друг с другом частиц, из которых состоит тело: атомов, молекул и ионов. Каков размер этих частиц? Как его измерить? Если высыпать горошины из стакана на стол, то толщина образованного ими на столе слоя окажется равной диаметру горошины. Подобный способ можно использовать для определения размеров частиц вещества. Конечно же, реальная форма частиц вещества не шарообразная, а гораздо более сложная. Но указанный способ позволяет, с известной точностью, оценить размеры частиц вещества. Частицы в жидкости располагаются достаточно плотно (см. рисунок ниже).
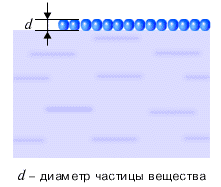
Можно считать, что на каждую частицу вещества приходится объем, равный объему куба, сторона которого равна диаметру частицы. Тогда, зная плотность жидкости и диаметр частицы вещества, а стало быть, и объем частицы, можно оценить массу частицы вещества. Оценки размера и массы молекулы сделаны ниже на рисунках для капли нефти.
Рис. 7. Оценка размера молекулы.
Рис. 8. Оценка массы молекулы.
В силу того, что массы частиц вещества крайне малы, удобно пользоваться не абсолютными, а относительными единицами массы. Для этого используется так называемая атомная единица массы (а.е.м.), равная 1/12 массы атома углерода. Массу частицы, измеренную в а.е.м. принято называть относительной атомной (или молекулярной) массой. Значения относительных атомных масс приведены в периодической системе химических элементов Д.И. Менделеева. Относительная молекулярная масса молекулы вещества равна сумме относительных атомных масс атомов, составляющих данную молекулу. Экспериментально установлено, что 1 а.е.м. = 1,66· 10-27 кг. В Международной системе СИ для измерения количества вещества (v) введена специальная единица - моль. 1 моль - это количество вещества, в котором содержится столько же частиц, сколько атомов содержится в 12 граммах углерода. Постоянная Авогадро численно равна количеству частиц, содержащихся в 1 моле любого вещества: Na= 6· 1023 моль-1. Масса 1 моля вещества называется молярной массой (М). Численное значение молярной массы, выраженной в г/моль, равно значению относительной атомной или молекулярной массы. Количество вещества, постоянная Авогадро, молярная масса, масса молекулы - эти величины связаны между собой соотношениями, которые приведены ниже на рисунках. Часто при решении той или иной задачи важнее знать не число частиц вещества, а их концентрацию. Концентрация (n) показывает, сколько частиц содержится в единице объема (чаще всего - в одном кубическом метре) данного вещества. Ниже на рисунках приведены формулы для массы молекулы mo, молярной массы M, количества вещества v, числа молекул N и концентрации молекул n. (V - объем вещества).
Основные итоги.
Решите задачу 1. Найдите массу молекулы воды.


Решите задачу 1a. Сколько молекул содержится в 1 см3 воды?


© Всероссийский конкурс "Дистанционный учитель года",
2000
© Львовский Марк Бениаминович, 2000
http://www.eidos.ru/dist_teacher/index.htm
E-mail: eidos@mailru.com